درمان بیماری پارکینسون با آنزیم مصنوعی
آنزیم مصنوعی، ممکن است اولین قدم در جهت درمان بیماری پارکینسون باشد.
خبرگزاری ایسنا: آنزیم مصنوعی، ممکن است اولین قدم در جهت درمان بیماری پارکینسون باشد.

محققان آنزیمی مصنوعی تولید کردهاند که از انتشار آلفا-سینوکلئین جلوگیری میکند. این یافتهها میتواند پیامدهای مثبتی در درمان بیماری پارکینسون داشته باشد.
بخشی از یک تحقیق در حال گسترش نشان داده است که آلفا-سینوکلئین معیوب و کژتابیده، پروتئین مسئول در بیماری پارکینسون و مشخصههای آن، از روده به مغز میرود، در آنجا گسترش مییابد و در تودههای کشنده معروف به «اجسام لویی» (تودههای دایره شکل که باعث جابهجایی دیگر اجزا سلولی میشوند) به هم میچسبد و زمانی که این تودهها رویهم انباشته شوند، باعث مرگ سلولهای مغزی میشوند.
اکنون، محققان پزشکی دانشگاه جان هاپکینز ایالاتمتحده، آنزیم مصنوعی تولید کردهاند که از انتشار آلفا-سینوکلئین کژتابیده جلوگیری میکند و میتواند پایهای برای درمان جدید بیماری پارکینسون باشد.
گروه تحقیقاتی، آنزیمهای مصنوعی، ترکیب نانومتری (یک نانومتر برابر با یک میلیاردم متر) از ترکیبات پلاتین و مس به نام نانو آلیاژهای دوفلزی PtCu را به دلیل خواص آنتیاکسیدانی قوی ایجاد کردند که قابلیت این آنتیاکسیدان تا حد زیادی به ترکیب آلیاژ بستگی دارد.
محقق ارشد این تحقیق، دکتر زیاوبو مائو، استادیار عصبشناسی در دانشکده پزشکی دانشگاه جان هاپکینز میگوید: «استرس اکسیداتیو ناشی از گونههای اکسیژن واکنشی غیرقابلاجتناب است و با افزایش سن به دلیل کاهش مکانیکی فرایندهایی مانند تخریب پروتئین، افزایش مییابد. این مورد اهمیت آنتیاکسیدانها را نشان میدهد، زیرا در بیماری پارکینسون، گونههای اکسیژن واکنشی در حال گردش، انتشار آلفا-سینوکلئین کژتابیده را گسترش میدهند و منجر به علائم بدتر میشوند.»
وقتی نانوزیمها به مغز تزریق میشوند، گونههای اکسیژن واکنشی را از بین میبرند و آنها را قطع و از آسیب رسیدن به سلولهای عصبی در مغز جلوگیری میکنند. نانوزیمها از کاتالاز و سوپر اکسید دیسموتاز تقلید میکنند، دو آنزیمی که در بدن ما یافت میشوند و گونههای اکسیژن واکنشی را تجزیه میکنند. با افزودن نانوزیمها، پاسخ بدن ما به آنها تقویت میشود.
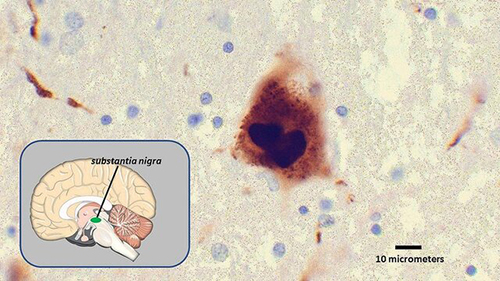
تصاویر میکروسکوپی یک جسم لویی (مرکز)، مجموعهای از پروتئینهای آلفا-سینوکلئین کژتابیده را نشان میدهد که به نظر میرسد عاملی در بیماری پارکینسون است. این حفره، محل توده سیاه را نشان میدهد، منطقهای از مغز که بر حرکت و شناخت تاثیر میگذارد، جایی که این جسم لویی پیداشده است.
این مطالعه از یک روش تحقیقاتی موسوم به مدل فیبریل پیشساخته آلفا-سینوکلئین استفاده کرده است که آسیبشناسی، گسترش و تخریب عصبی ناشی از اجسام لویی را تکرار میکند. مشخص شد که این نانوزیم علاوه بر کاهش گونههای اکسیژن واکنشی، آسیبشناسی ناشی از آلفا-سینوکلئین را کاهش داده و مسمومیت عصبی را مهار میکند. نانوزیم همچنین مانع از انتقال آلفا-سینوکلئین از سلولی به سلول دیگر و از توده سیاه به جسم مخطط پشتی، دو ناحیه در مغزمیانی میشود که بر حرکت و شناخت تاثیر میگذارد.
مائو مدتهاست که با یک همکار و متخصص بیماری پارکینسون، تد داوسون، دکترای تخصصی عصبشناسی و مدیر انستیتوی مهندسی سلول در دانشکده پزشکی دانشگاه جان هاپکینز، همکاری کرده است. داوسون بهتازگی به شواهدی مبنی بر اینکه آلفا-سینوکلئین کژتابیده در امتداد عصب واگ از روده به مغز میرود، دست پیدا کرده است. مائو امیدوار است که تحقیقات بیشتر بتواند این دو یافته را به هم ربط دهد و منجر به درمان بیماری پارکینسون شود که روده را هدف قرار دهد.
مائو میگوید: «ما میدانیم که نانو آنزیمها هنگام تزریق مستقیم به مغز عمل میکنند. اکنون، ما میخواهیم ببینیم که آیا نانو آنزیمها میتوانند پیشرفت بیماری ناشی از حرکت آلفا-سینوکلئین بیماریزا از روده، از میان سد خونی مغز و بهطرف مغز را مسدود کنند.»
نتایج این تحقیق در مجله Nano Today منتشر شده است.










ارسال نظر